2021年2月3日,根据国家药品监督管理局药品审评中心(CDE)最新公示,广州爱思迈生物医药科技有限公司递交的1类新药“EX101注射液”临床试验申请已获承办(受理号:CXSL2100036)。

图源:CDE官网
“EX101注射液”是一款靶向HER2×CD3的双特异性抗体,主要针对HER2阳性的实体瘤。该分子基于爱思迈双抗技术平台ExMab®自主研发,是爱思迈的首个双抗分子药物。
EX101注射液拟用于治疗HER2阳性晚期实体瘤,包括乳腺癌、胃癌或胃食管交界处腺癌等。乳腺癌、胃癌等均为我国高发的恶性肿瘤,而EX101注射液的出现,有望解决目前的单抗药物耐药性及高复发的问题。
经过多年的潜心研发与深度优化,爱思迈的EX101注射液在临床前研究中表现出卓越的疗效,以及优越的安全性,体内药效实验显示EX101最低有效抑瘤剂量为10 μg/Kg,在食蟹猴毒性研究中的最大耐受剂量(MTD)可达到300 μg/Kg,根据人类等效剂量(HED)换算,预计该分子的治疗窗口为起效计量的20倍,其疗效和安全性远超国内外同靶点产品。
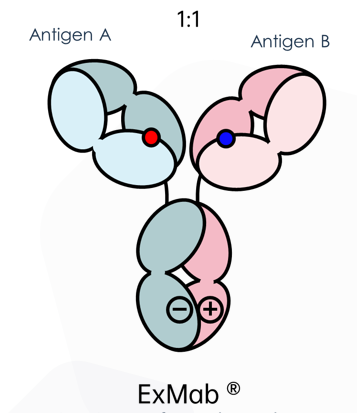
ExMab®是爱思迈拥有独立自主知识产权的双抗技术平台,该技术在两条重链上分别引入负电荷或正电荷的突变位点,使得两条链结通过静电吸引。目前,该技术专利已经获得包括美国、日本、加拿大、澳大利亚、韩国等在内的多个国家授权。
在EX101的研发过程中,爱思迈团队在张文军博士的领导下,在分子设计、工艺开发过程中精益求精,在药理毒理研究中一丝不苟,克服了重重困难,终于成就了一款世界级的先进分子。
在得知CDE已受理EX101注射液的临床申请时,张博士激动地表示:“非常感恩我们遇到了中国医药创新的黄金时期,让我们这些制药老兵有了用武之地。也非常感恩我们有爱思迈这样一个优秀团队,在困难面前百折不挠,共同度过了许多不眠之夜。EX101将成为爱思迈进军全球药物市场的一张靓丽的名片,也将以卓越的疗效成为我们爱思迈的骄傲。”
爱思迈正以ExMab®平台为基础,同时推进多条研发管线,开发针对不同靶点、适应症的双抗新药,以期突破现有治疗方式的局限及耐药性,同时申报欧美IND,开展国际多中心临床研究,以优质药物造福国内外患者。




 返回列表
返回列表